Química Inorgánica Unidad 2
Enlaces Químicos y Nomenclatura
Temario
2.1 Enlaces atómicos
2.1.1 Enlaces iónicos
2.1.2 Enlaces covalentes
2.1.3 Enlaces metálicos
2.2 Enlaces moleculares
2.2.1 Puentes de hidrógeno
2.2.2 Fuerzas de Van der Waals
2.3 Estructura de Lewis, números de oxidación, formación de compuestos y nomenclatura química
2.3.1 Estructura de Lewis y ley del octeto
2.3.2 Números de oxidación
2.3.3 Formación de compuestos
2.3.4 Nomenclatura de los oxácidos y oxisales
2.3.4.1 Formulación de los oxácidos
2.1 Enlaces Atómicos
Por definición, un enlace atómico es la fuerza de atracción que ejercen dos o más átomos entre sí. Esta fuerza los mantiene juntos para reducir la energía potencial que existe entre sus electrones al ser compartidos. Existen dos tipos de enlaces, el enlace atómico (iónico, covalente y metálico) y el enlace molecular (puentes de hidrógeno y fuerzas de Van der Waals).
2.1.1 Enlaces Iónicos

Un enlace iónico se forma cuando se transfiere uno o más electrones de valencia de un átomo a otro, del menos electronegativo al más electronegativo, creando así iones positivos y negativos. Este enlace se forma comúnmente cuando la diferencia de las electronegatividades que existen entre los dos átomos participantes es mayor de 1.6.
Por ejemplo, cuando el sodio cede su electrón de valencia, se produce el ion sodio, con carga positiva; el cloro acepta este electrón y se forma el ion cloro, con carga negativa. Los dos iones cuentan con ocho electrones en su capa más externa y se atraen entre sí, pues poseen cargas opuestas. El compuesto resultante es eléctricamente neutro, es decir, carece de carga (sal común).
Los compuestos iónicos son sólidos cristalinos, solubles en agua y conducen la electricidad fundidos o en disolución. Estas características se deben al tipo de enlace que los mantiene unidos.
Propiedades
No se forman moléculas aisladas, se forman redes cristalinas mediante enlaces muy fuertes y estables. Se requiere mucha energía para separar los iones de la red o empaquetamiento, ya que son
sólidos no conductores, de elevado punto de fusión, duros y quebradizos.
Los iones pueden ser separados de la red fundiendo el compuesto o bien disolviéndolo en sustancias polares como el agua, logrando la separación de los iones de la red. Por este motivo estos compuestos en disolución acuosa conducen la corriente eléctrica.
2.1.2 Enlaces Covalentes
Una molécula tiene un enlace covalente cuando todos los átomos que la constituyen comparten sus electrones, de manera que cada uno presenta ocho electrones en su capa de valencia. Se conocen dos tipos de enlaces covalentes: el covalente puro, que se presenta entre átomos iguales, como el F2 (ver nomenclatura) y el covalente polar (simple), que ocurre entre átomos diferentes. Por ejemplo, el agua es una molécula con dos enlaces covalentes polares, donde el átomo de oxígeno comparte un par de electrones con cada átomo de hidrógeno.
Un enlace covalente se forma cuando dos o más átomos comparten sus electrones de valencia. Como se mencionó anteriormente, este tipo de enlace puede ser puro, simple o polar, dependiendo de la diferencia de electronegatividad de los átomos unidos por las fuerzas de atracción.
Los compuestos formados por enlaces covalentes son más abundantes que los iónicos y pueden ser sólidos, líquidos o gaseosos. Casi todos son insolubles en agua y son malos conductores de la energía eléctrica. Basta señalar que la mayoría de constituyentes de los seres vivos y de los nutrimentos presentes que están en la dieta de cualquier persona son compuestos con enlaces covalentes.
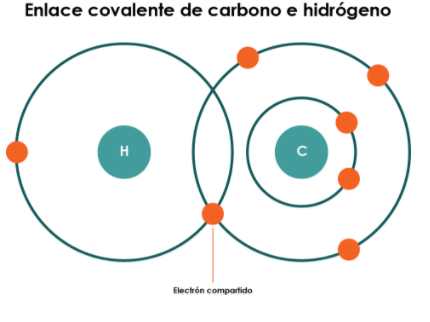
Propiedades
· Los compuestos covalentes están formados por elementos con electronegatividad similar.
· No presentan conductividad eléctrica en la fase líquida.
· Presentan amplia solubilidad en disolventes apolares y muy baja solubilidad en disolventes polares.
Muchos compuestos son gases o líquidos. Los sólidos tienen puntos de fusión bajos.
La utilidad práctica de tener este conocimiento básico de Química Inorgánica es bastante amplia, ya que son muy comunes los enlaces químicos con átomos de carbono, hidrógeno y oxígeno, con los que se forman millones de compuestos, en los cuales cada átomo de carbono forma siempre cuatro enlaces covalentes. Dada la enorme cantidad de compuestos formados con carbono, una parte de la Química General está dedicada a su estudio: la Química Orgánica.
2.1.3 Enlaces Metálicos
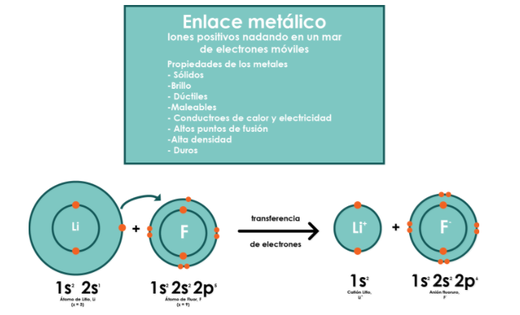
El enlace metálico ocurre en los metales puros y en las aleaciones compuestas. En el enlace covalente los átomos comparten pares de electrones; sin embargo, en el enlace metálico muchos átomos comparten muchos electrones entre sí.
Los electrones de valencia de un metal puro (la plata o el cobre) forman un manantial de electrones que fluyen libremente a través de la pieza de metal. Como los electrones no pertenecen a ningún átomo en particular, los átomos existen como iones positivos y se neutralizan con las cargas negativas de todos los electrones.
Este tipo de enlace explica las propiedades de los metales:
· La alta densidad que poseen los metales es provocada por el reducido espacio que existe entre los iones positivos.
· La maleabilidad (capacidad de ser moldeados con herramientas) se debe a que las capas de cationes metálicos se deslizan unas sobre otras.
La conducción del calor y la electricidad está asociada con el libre movimiento de los electrones entre las capas de la red.
2.2 Enlaces Moleculares
La electronegatividad es una propiedad que tienen los átomos de atraer electrones, la cual genera fuerzas intermoleculares (puentes de hidrógeno y fuerzas de Van der Waals), que se definen como un conjunto de interacciones atractivas o repulsivas que se producen entre las moléculas como consecuencia de la presencia o ausencia de electrones.
Así, cuando dos o más átomos se unen mediante un enlace químico, forman una molécula. Los electrones que conforman la nueva molécula hacen un recorrido y se concentran en la zona del átomo con mayor electronegatividad.
La concentración de electrones en una zona específica de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva en donde los dipolos son moléculas que disponen de zonas cargadas negativamente y positivamente, debido a la electronegatividad y la concentración de los electrones. Así, se puede comparar el funcionamiento de un dipolo a un imán con su polo positivo y su polo negativo, de tal forma que si acercamos otro imán el polo positivo atraerá al polo negativo y viceversa, dando como resultado una unión.
2.2.1 Puentes de Hidrógeno

Los puentes de hidrógeno son enlaces sui generis que cuentan con características muy particulares, aunque son similares a las interacciones de tipo dipolo-dipolo, tienen características especiales. Al ser un tipo particular de interacción polar que se establece entre un par de átomos significativamente electronegativos, generalmente oxígeno o nitrógeno, y un átomo de hidrógeno unido covalentemente a uno de los dos átomos electronegativos.
En un puente de hidrógeno se requiere hacer distinción entre el átomo dador del hidrógeno (unido covalentemente al hidrógeno) y el aceptador, que es al átomo de oxígeno o nitrógeno al cual se enlaza el hidrógeno.
Un enlace dador O-H está muy polarizado por la elevada electronegatividad del oxígeno y por el hecho de que el único protón del núcleo del hidrógeno atrae débilmente a los electrones del enlace. Así, se estima que la carga positiva sobre el hidrógeno es de 0,4 unidades. En el caso de que el átomo electronegativo sea nitrógeno la situación es similar, aunque dada la menor electronegatividad del nitrógeno la polarización del enlace va a ser algo menor. Los grupos O-H y el N-H van a actuar como donadores de hidrógeno en el enlace de hidrógeno. A pesar de la similitud química el grupo “S (azufre) - H (hidrógeno)” es un mal donador, debido a la baja electronegatividad del azufre.
El aceptor del hidrógeno va a ser un átomo electronegativo (otra vez oxígeno o nitrógeno), pero con una peculiaridad: el hidrógeno se va a unir a un orbital ocupado por dos electrones solitarios. Estos orbitales tienen una densidad de carga negativa alta, y por consiguiente se pueden unir a la carga positiva del hidrógeno.
2.2.2 Fuerzas de Van Der Waals
En las fuerzas de Van der Waals se observa una dinámica intermolecular en donde se presentan cuatro tipos en particular: fuerzas de orientación, fuerzas de inducción, fuerzas de dispersión y fuerzas de repulsión, descritas a continuación:
· Fuerzas de orientación: es una fuerza de tipo atractivo que precede a la energía de orientación y está presente en las agrupaciones moleculares, se presenta en moléculas con dipolo permanente, orientándose de acuerdo a sus cargas, como son HCI (ácido clorhídrico), NH3 (amoniaco), H2O (dihidruro de oxígeno o agua), entre otras.
· Fuerzas de inducción: las fuerzas de inducción se presentan entre una molécula con dipolo permanente y otra sin dipolo permanente, esto significa que la atracción electrostática entre el extremo positivo de una molécula se distorsiona con la influencia del extremo negativo, formando un dipolo inducido. Las cargas contrarias quedan orientadas en el mismo sentido, pero la energía en este caso es de inducción.
· Fuerzas de dispersión: es la fuerza que conduce a la energía de dispersión, explica el comportamiento de los gases nobles y al mismo tiempo resulta ser el principal contribuyente a la atracción de Van der Waals. La energía de dispersión se atribuye a la atracción entre dos dipolos inducidos.
· Fuerzas de repulsión: la cuarta fuerza necesariamente grande y repulsiva se manifiesta cuando las nubes electrónicas saturadas de electrones empiezan a traslaparse. Esta energía se conoce como energía de repulsión de London y predomina sobre las energías anteriores.

De todas las fuerzas que desempeñan un papel a nivel molecular, las llamadas fuerzas de Van der Waals son las más débiles y probablemente las más constantes en el universo. Estas energías están asociadas con energías entre 0.4 y 40 kJ/mol, que por lo regular se mantienen ocultas por otras fuerzas covalentes más fuertes, con energías típicas que alcanzan un valor de 400 kJ/mol; es por ello importante conocerlas para explicar interacciones entre moléculas y átomos con orbitales saturados, donde no es probable la unión covalente adicional.
2.3 Estructura de Lewis, Números de Oxidación, Formación de compuestos y Nomenclatura Química
La Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda una serie de reglas aplicables a la nomenclatura química de los compuestos inorgánicos, en donde cualquier compuesto químico debe tener un nombre que exprese una fórmula química sin imprecisiones o ambigüedades.
Los compuestos inorgánicos se clasifican por la función que representan y la cantidad de elementos que los forman. Para nombrarlos se utilizan reglas (nomenclatura).
Como ejemplo, los compuestos ácidos tienen propiedades características de un ácido, debido a que tienen el ion que dona H+ (hidrógeno), y las bases tienen propiedades características de este grupo debido al ion OH- presente en estas moléculas y que recibe protones. Los principales compuestos químicos son los óxidos, las bases, los ácidos y las sales.
2.3.1 Estructura de Lewis y Ley del Octeto
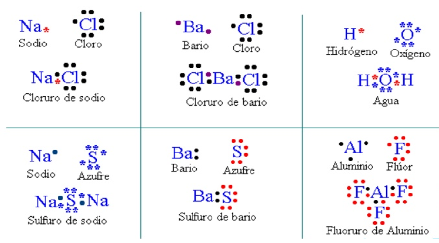
La ley del octeto fue propuesta en 1917 por Gilbert Newton Lewis (1875-1946). Esta regla se basa en el principio de que los átomos ganan, pierden o comparten electrones al combinarse, tratando de estructurarse como el gas noble más cercano al elemento, para que en su último nivel de energía queden ocho electrones y el compuesto químico sea más estable.
Para realizar el cálculo del estado de oxidación con mayor precisión de cada uno de los átomos de una sustancia, es necesario conocer la estructura de Lewis de dicha sustancia.
Las estructuras de Lewis son una representación de la distribución de los electrones de valencia de los átomos en una molécula. A partir de la estructura de Lewis y tomando en cuenta que para el cálculo de números de oxidación se toma en consideración que todos los enlaces son en su totalidad iónicos, el par de electrones compartidos en cualquier enlace formado entre dos átomos distintos se asignan a la electronegatividad.
En el caso de que los átomos que comparten electrones tengan la misma electronegatividad (como es el caso de los enlaces C-C), de cada par electrónico en el enlace se asigna un electrón a cada uno de los átomos participantes, por ejemplo, para el ácido propiónico C3H6O2.
Explicado de otra manera, con base en la ley del octeto los enlaces se relacionan con el conjunto de interacciones que sean necesarias para donar los electrones sobrantes o recibir los electrones faltantes, a efecto de lograr la configuración del gas noble o quedar completo en su último nivel de energía.
2.3.2 Números de Oxidación.
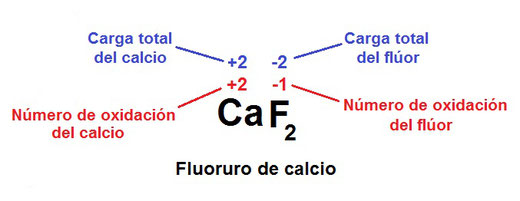
El número (estado) de oxidación es la carga que se asigna a los átomos en una molécula o ion, partiendo del supuesto de que todos los enlaces presentes en ésta son 100 % iónicos, por lo tanto, la asignación de números de oxidación es útil para calcular el número de electrones intercambiados en reacciones redox (reducción-oxidación). Una aplicación práctica a esta reacción puede ser el enchapado químico de metales para su uso industrial u orfebre.
2.3.3 Formación de Compuestos.

Los compuestos químicos o sustancias compuestas son aquellas sustancias que se pueden dividir en otras más simples o elementos químicos; están representadas a través de sus fórmulas químicas, como el dióxido de carbono (CO2) y el agua (H2O).
Elementos químicos o sustancias simples: son aquellas sustancias que no se pueden dividir en otras diferentes; están representadas a través de los símbolos químicos. El fósforo (P), hierro (Fe) y carbono (C).
Símbolo químico: es la representación gráfica y abreviada de los nombres de los elementos químicos, como: P, Fe, C.
Fórmula química: es la representación gráfica y abreviada de los compuestos químicos.Ejemplo:CO2, H2O.
Como concepto se expresa el término valencia, que es la capacidad que tienen los átomos de los elementos para combinarse con otros y formar los diferentes compuestos químicos. Así, la valencia o las valencias de los elementos dependen de los electrones que puedan compartir, ganar o perder al combinarse con otros elementos; por esta razón a estos electrones se les llama electrones de valencia.
Ejemplos:
a) Cloro, bromo, yodo, cuando se
combinan con elementos distintos al oxígeno, actúan con valencia I. Cuando lo hacen con el oxígeno pueden usar I, III, V, VII.
b) Azufre, selenio, telurio, cuando se combinan con el oxígeno lo hacen con valencias IV, VI, y cuando no, con valencia II.
c) Nitrógeno, fósforo, arsénico, antimonio, cuando se combinan con el oxígeno, lo hacen con valencias III, V, y cuando no, con valencia III.
Elemento valencias, símbolo M o m. Elemento valencias, símbolo M o m. Un metal (M) o si se trata de un no metal (m).
2.3.4 Nomenclatura de los Oxácidos y Oxisales
Los oxácidos son compuestos químicos formados por hidrógeno, un elemento no metálico y oxígeno; en ciertas ocasiones puede ser un elemento metálico del grupo del cromo, el manganeso, el wolframio y el vanadio, ya que actúan como no metálicos cuando se encuentran en un alto estado de oxidación.
2.3.4.1 Formulación de los oxácidos
Para la fórmula general de los oxácidos se utiliza la proporción siguiente:
HaXbOc
En donde el elemento hidrógeno actúa con número de oxidación +1, el oxígeno actúa con número de oxidación -2 y el número de oxidación del elemento no metálico se calcula según la siguiente fórmula:
X = (2c - a) / b
· Nomenclatura de los oxácidos
Para poder nombrar los oxácidos se puede utilizar la nomenclatura tradicional, nomenclatura de stock, así como la nomenclatura sistemática.
· Nomenclatura tradicional
Con la nomenclatura tradicional, los oxácidos se nombran con la palabra ácido, seguida de la raíz del elemento no metálico e indicando la valencia con la que actúa según el siguiente criterio, dependiendo de la valencia:
Una valencia:
Ácido ...ico
Dos valencias:
Menor valencia: ácido ...oso
Mayor valencia: ácido ...ico
Tres valencias:
Menor valencia: ácido hipo...oso
Valencia intermedia: ácido ...oso
Mayor valencia: ácido ...ico
Cuatro valencias:
Primera valencia (baja): ácido hipo...oso
Segunda valencia: ácido ...oso
Tercera valencia: ácido ...ico
Cuarta valencia (alta): ácido per...ico
Ejemplos:
HBrO: ácido hipobromoso
HBrO2:
ácido bromoso
HBrO3:
ácido brómico
HBrO4:
ácido perbrómico
H2N2O2 → HNO: ácido hiponitroso
HNO2: ácido nitroso
HNO3: ácido nítrico
· Nomenclatura de stock
En la nomenclatura de stock se comienza con la palabra ácido, seguida del prefijo que indica el número de oxígenos más la palabra oxo, luego el prefijo que indica el número de átomos del elemento no metálico (normalmente no se pone porque es un átomo), a continuación la raíz del elemento no metálico, terminado en ico, y en números romanos indicamos su valencia, de la siguiente manera:
Ácido + prefijo oxígenos + oxo + prefijo X + raíz X + ico + (valencia X)
Ejemplos:
HClO2:
ácido dioxoclórico (III)
H2SO3: ácido trioxosulfúrico (IV)
H3PO4: ácido tetraoxofosfórico (V)
H2S2O7: ácido heptaoxodisulfúrico (VI)
Cuando se tiene un átomo de oxígeno no se indica el prefijo mono.
Ejemplo:
HClO: ácido oxoclórico (I), en lugar de ácido monoxoclórico (I)
Nomenclatura sistemática
Por su parte, la nomenclatura sistemática comienza con el prefijo que indica el número de oxígenos, seguido de la palabra oxo, luego el prefijo que indica el número de átomos del elemento no metálico, a continuación la raíz del elemento no metálico, acabado en ato, y en numerales romanos se indica la valencia del elemento no metálico, seguido de las palabras de hidrógeno, es decir:
Prefijo oxígenos + oxo + prefijo X + raíz X + ato + (valencia X) + de hidrógeno
Ejemplos:
H2SO2: dioxosulfato (II) de hidrógeno
H2SO3: trioxosulfato (IV) de hidrógeno
H2SO4: tetraoxosulfato (VI) de hidrógeno
H2S2O7: heptaoxodisulfato (VI) de hidrógeno
Características de las oxisales
· Las sales son compuestos que al diluirse en agua destilada por reacción forman agua oxigenada/peróxido de hidrógeno (H2O2).
· La mayoría de estas sales son solubles en agua.
· Las oxisales de metales alcalinos son poco solubles en agua.
· Ya sea que sean fundidas o se disuelvan en agua, son buenas conductoras de la electricidad.
Típicamente las oxisales cuentan con un punto de fusión alto, no son duras y de baja compresibilidad.
Nomenclatura tradicional de oxisales
Las sales-oxidadas u oxisales son compuestos químicos resultantes de reacciones de sustitución, total o parcial, de los protones de un ácido oxácido por un catalizador metálico, los ácidos de los que provienen, pero cambiando las terminaciones y manteniendo los prefijos. Para ello se parte del ácido del que proviene la sal, cambiando el sufijo -oso por -ito en caso de números de oxidación bajos y el -ico por -ato para los números de oxidación altos.
Ejemplos:
HNO2: ácido nitroso → catalizador de potasio → nitrito de
potasio: KNO2
HNO3: ácido nítrico → catalizador de cobre →
nitrato cúprico: Cu(NO3)2
Recursos de la Unidad 2
Continua el Curso !
Bibliografía
· Nelson, P. (2008). Biological Phisics: energy, information, life. (4th edition). United States of America: Freeman.
Sears, F. W. & Zemanzqui, M. W. (1977). Física General. (5ª edición). España: Aguilar.
Direcciones electrónicas
· Biografías y Vidas (s/f). “Dmitri Ivanovich Mendeléiev”. Recuperado en febrero de 2016. Consultado en: http://www.biografiasyvidas.com/biografia/m/mendeleiev.htm
· Campoamor, C. (s/f). “La tabla periódica”. Recuperado en febrero de 2016. Consultado en: http://fresno.pntic.mec.es/~fgutie6/quimica2/ArchivosPDF/07TablaPeri%F3dica.pdf
· IES. La Magdalena. Avilés. Asturias (s/f). “Modelo atómico de Rutherford”. Recuperado en febrero de 2016. Consultado en: http://web.educastur.princast.es/proyectos/fisquiweb/Apuntes/Apuntes2Qui/Bohr_Sommerfeld.pdf
· IES. La Magdalena. Avilés. Asturias (s/f). “Principio de Incertidumbre”. Recuperado en febrero de 2016. Consultado en: http://web.educastur.princast.es/proyectos/jimena/pj_franciscga/heisenberg.htm
· Institute for Human & Machine Cognition (s/f). “Modelo atómico de Thomson”. Recuperado en febrero de 2016. Consultado en: http://cmapspublic.ihmc.us/rid=1HC67ZLDF-16KXG1M-ZS9/Modelo%20de%20Thomson.pdf
· Lenntech, BV (s/f). “Historia de la tabla periódica”. Recuperado en febrero de 2016. Consultado en: http://www.lenntech.es/periodica/historia/historia-de-la-tabla-periodica.htm
· López, N. (s/f). “Tabla periódica y configuraciones electrónicas”. Recuperado en febrero de 2016. Consultado en: http://depa.fquim.unam.mx/amyd/archivero/TPyConfigElectronicas_21448.pdf
Ministerio de Educación, Cultura y Deporte de España (s/f). “El Átomo y los Modelos atómicos”. Recuperado en febrero de 2016. Consultado en: http://recursostic.educacion.es/secundaria/edad/3esofisicaquimica/impresos/quincena5.pdf
· Ministerio de Educación, Cultura y Deporte de España (s/f). “Periodos y Grupos”. Recuperado en febrero de 2016. Consultado en: http://recursostic.educacion.es/secundaria/edad/4esofisicaquimica/4quincena8/4q8_contenidos_3c_ampliacion.htm
· Pellini, C. (s/f). “Principio de Arquímedes Teorema de la hidrostática Empuje de fluidos”. Recuperado en febrero de 2016. Consultado en: http://historiaybiografias.com/principio02/
· (S/a) (s/f). “Definición de ion”. Recuperado en abril de 2016. Consultado en: http://conceptodefinicion.de/ion/
· (S/a) (s/f). “Estructura Atómica”. Recuperado en febrero de 2016. Consultado en: http://assets.mheducation.es/bcv/guide/capitulo/8448180488.pdf
·
(S/a) (s/f). Guía conceptual de
cálculos estequiométricos. Recuperado en abril de 2016. Consultado en:
http://files.ciencias-naturales-colegio-upb.webnode.es/200000056-
5652c574cb/Gu%C3%ADa%20conceptual%20C%C3%A1lculos
%20estequiom%C3%A9tricos%20Qu%C3%ADmica%20und%C3
%A9cimo.docx
· (S/a) (s/f). “Partícula alfa”. Wikipedia. Recuperado en abril de 2016. Consultado en: https://es.wikipedia.org/wiki/Part%C3%ADcula_alfa
· Universidad de Alcalá (s/f). “La estructura electrónica de los átomos”. Recuperado en febrero de 2016. Consultado en: http://www3.uah.es/edejesus/resumenes/EQEM/tema_193.pdf
Youngker, A. (s/f). “Cálculo de partículas subatómicas”. Recuperado en febrero de 2016. Consultado en: http://www.ehowenespanol.com/calcular-particulas-subatomicas-como_185327/
Recuerda Leer Política de privacidad antes de usar este sitio.

