Química Inorgánica.
Unidad 1
Temario
1.1 Teoría de Arquímedes
1.2 Modelo atómico de Dalton
1.3 Modelo atómico de Thompson
1.4 Modelo atómico de Rutherford
1.5 Modelo atómico de Bohr
1.6 Modelo mecánico cuántico de Schrödinger
1.7 Configuración electrónica de los elementos
1.8 Cálculo de partículas subatómicas
1.8.1 Conceptos de ion e isótopo
1.8.2 Cómo calcular partículas subatómicas
1.9 Grupos de la tabla periódica
1.10 Periodos de la tabla periódica
1.11 Bloques de la tabla periódica
1.1 Teoría de Arquímedes
Arquímedes de Siracusa (287-212 a. C.), gran descubridor de la observación científica al desarrollar la geometría y las matemáticas puras asociadas a la física mecánica (leyes de la palanca, polea compuesta y tornillo sinfín); como consejero del Rey Hierón II logró ser responsable de la defensa de su ciudad.
Sus obras más conocidas asocian la geometría y las matemáticas al descubrir la ley de la hidrostática, conocida comúnmente como el principio de Arquímedes, que afirma que todo cuerpo sumergido en un fluido experimenta el desplazamiento del líquido como una pérdida de su peso igual al peso del volumen que desaloja; ésta se define y conceptualiza de esta manera: todo cuerpo sumergido en el agua recibe de parte de este líquido un impulso de abajo hacia arriba con una magnitud igual al peso del volumen de agua que desaloja.

De esta manera, el empuje se define como:
E = Pµ
Donde E es la fuerza de empuje y Pfd es el peso del fluido desplazado.
Es importante no confundir el peso del fluido desplazado con el peso del objeto sumergido, ya que el primero depende más bien de la masa del fluido desplazado mfd, que viene dada por la siguiente ecuación:
Pfd = mfd g
en donde Pfd es el peso del fluido desplazado, mfd es la masa del fluido desplazado y g es la fuerza de gravedad terrestre. Por lo anterior, se obtiene la ecuación siguiente:
P = mg
donde P es el peso del objeto, m es su masa y g la fuerza de la gravedad terrestre.
Además, se requiere tener en cuenta las unidades de medida de cada una de las magnitudes siguientes: mfd viene dada en kilogramos (kg) y g en (m/s2), lo cual da como resultado la unidad newtoniana (N), ya que cuando se multiplica la masa por la gravedad terrestre, se obtiene como resultado un Newton (N).
Ejemplo:
En un tubo de ensaye aforado con agua destilada se introduce un trozo de metal y con una pipeta se extrae la cantidad de agua desplazada hasta llegar a la lectura (aforo) inicial. Al medir la masa (m) del agua extraída, se obtiene el valor de 10 gramos; calcular:
1. El peso del agua desplazada (Pfd)
2. El empuje hidrostático (E) que experimenta el trozo de metal
Planteamiento y procedimiento: como la masa viene dada en gramos, esta cantidad se debe convertir en kilogramos (kg) para homologar las unidades de la ecuación 1.1, en donde 10 g es 0.010 kg. Luego entonces, utilizando Pfd = mfd g
se obtiene que:
Pfd = (0.10 kg) * (10 m/s2)
Pfd = 0.1 N
que de acuerdo con el principio de Arquímedes, expresado en la ecuación E=Pfd, se obtiene:
E = 0.1 N
Cuando se conocen las densidades del fluido y del objeto sumergido, así como el volumen de desplazamiento, el principio de Arquímedes adquiere un gran valor en la física, principalmente al comprender que la densidad el fluido ( ρ ) es diferente a la densidad del objeto ( ρ0 ), ya que la flotación de un objeto depende de la relación entre su densidad y la densidad del fluido en el que se sumerge.
Así, es posible expresar el principio de Arquímedes en función de la densidad del fluido, de la siguiente manera:
E = Pµ
E = mµ · g
E = ρ · Vµ · g
En términos generales, el principio de Arquímedes establece que todo cuerpo sumergido en un fluido experimenta un empuje vertical y hacia arriba igual al peso de fluido desalojado. Este principio consta de dos partes esenciales: el estudio de las fuerzas sobre una porción de fluido en equilibrio con el resto del fluido y el desplazamiento de dicha porción de fluido por un cuerpo sólido de la misma forma y dimensiones.
Actualmente el principio de Arquímedes sigue siendo válido en todos los casos y se enuncia: cuando un cuerpo está sumergido en el fluido que le rodea actúa hacia arriba una fuerza de empuje y su magnitud es igual al peso del fluido que ha sido desalojado por el cuerpo… Para ello es necesario conocer conceptos como gravedad terrestre, peso, masa, densidad y peso específico.
1.2 Modelo Atómico de Dalton.

John Dalton (1766-1844) publicó su teoría atómica en el año 1808, bajo los principios ideológicos de los filósofos de la antigüedad Leucipo de Mileto (450-370 a. C.) y Demócrito de Abdera (460- 370 a. C.), considerados como los precursores sobre la idea del átomo. Esta teoría la fortalece con los fundamentos científicos teóricos y experimentales de Dalton en laboratorio, basándola en los siguientes enunciados:
1. La materia está formada por partículas minúsculas e indivisibles llamadas átomos.
2. Los átomos de un elemento químico son todos iguales entre sí y diferentes a los átomos de los demás elementos.
3. Los compuestos químicos se forman mediante la unión de átomos de dos o más elementos en proporciones constantes y sencillas.
4. Los átomos se intercambian en las reacciones químicas sin que ninguno de ellos desaparezca ni se transforme.
Dalton afirmó que cada elemento químico está formado por una clase específica de átomos, distinta a las propiedades de los átomos de los demás elementos; esta distinción separa un elemento de otro haciéndolos diferentes. La nomenclatura simbólica de los elementos químicos la estableció con signos distintos entre sí, que a la postre de la evolución en el conocimiento científico se han ido modificando hasta llegar a los símbolos químicos modernos y actuales.
La teoría atómica de Dalton es muy semejante a la idea sobre los átomos imaginados por los filósofos griegos, sin embargo, difieren en su estructura, forma y tamaño. La hipótesis atómica de los antiguos griegos era una doctrina solamente filosófica, y no fue hasta la propuesta de Dalton que se construye una verdadera teoría científica, mediante la cual podían explicarse y coordinarse cuantitativa, cualitativa, ponderal y volumétricamente los fenómenos observados y las leyes de sus combinaciones.
De esta manera, teoría atómica daltoniana instituyó inicialmente una hipótesis de trabajo científico que abonó al desarrollo posterior de la Química General, y que en la posteridad fue universalmente aceptada al conocerse pruebas físicas indiscutibles sobre la existencia y estructura real de los átomos como objetos complejos formados por partículas.
1.3 Modelo Atómico de Thomson

Joseph John Thomson (1856-1940) ganó el premio Nobel de Física en el año 1906 por descubrir la partícula atómica llamada electrón y los isótopos, inventó el espectrómetro de masas, fue miembro distinguido de la Royal Society en el campo de la física y nombrado Caballero en 1908, además ingresó a la Orden del Mérito en 1912.
Su contribución científica ayudó a la sencilla comprensión de la estructura del átomo (1857) y determinó que la materia en general se componía de dos partes básicas: una positiva (protón) y otra negativa (electrón), criterio que le sirvió de base para explicar la formación de iones positivos y negativos, aunque dejó sin explicación el porqué de la existencia de radiaciones electromagnéticas (rayos X) y otros fenómenos relacionados con la luminosidad electroestática.
Sus experimentos los realizó utilizando tubos catódicos, donde mediante una emisión lumínica logró separar los electrones del átomo, determinando la relación que existe entre la carga eléctrica y la masa (electrón-protón) y concluyó que era posible separar átomos de diferente masa en sus componentes de carga eléctrica positiva y negativa.
El modelo atómico de Thomson era concebido como una esfera maciza con carga eléctrica positiva dentro de la cual estaban incluidos los electrones negativos.
A principios del Siglo XX este modelo atómico era aceptado normalmente.
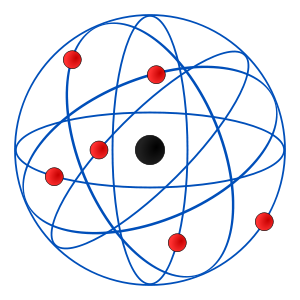
1.4 Modelo Atómico de Rutherford

Ernest Rutherford (1871-1937) demostró que el átomo no tenía una consistencia firme, sino que su espacio se encontraba en un inmenso vacío. Experimentó además con varios elementos, particularmente el hidrógeno (H), y encontró que el átomo está formado por un núcleo (protón) con carga eléctrica positiva, que se encuentra rodeado de otra partícula (electrón) con carga eléctrica negativa y de escasa masa, que órbita de manera circular y a gran distancia del núcleo.
Rutherford describió la estructura del átomo en comparación con la órbita de los planetas alrededor del sol, muy semejante a un modelo planetario y consideró que los núcleos de hidrógeno son una partícula fundamental que se encuentra alojada en los núcleos de los átomos, proponiendo el nombre de “protón” para dicha partícula; propuso además en 1920 el nombre del neutrón (carga eléctrica neutra).
Actualmente se conoce que el diámetro de un átomo típico es de 10-10 m, mientras que el núcleo atómico es 10 000 veces más pequeño 10-14 m, los protones y los neutrones tienen un diámetro calculado alrededor de 10-15 m y el electrón del orden de 10-18 m.
Sin embargo, el modelo de átomo de Rutherford solamente explica las órbitas de los electrones en torno al núcleo (circulares), sin explicar el porqué de algunos fenómenos físicos con espectros ultravioletas, lumínicos o en sus componentes de rayos X inherentes a cada elemento químico.
Rutherford es considerado por muchos autores como el padre da la física nuclear y de la química moderna, ya que condujo a la comunidad científica de su época hacia un nuevo conocimiento. Hasta entonces se creía que con el modelo atómico de Thomson se podría comprender ampliamente un modelo atómico muy simple, en el cual había sólo electrones de carga negativas incrustados en un átomo de carga positiva, como pasas en un budín.
Sin embargo, Rutherford dedujo que el núcleo de un átomo debería estar constituido por una partícula con carga positiva a la que llamó protón. Así, en su experimento con laminillas de oro pudo explicar por qué las partículas alfa rebotaban y no pasaban por el centro del átomo; encontró además que los electrones se movían y circulaban con una velocidad próxima a la de la luz alrededor del núcleo.
1.5 Modelo Atómico de Borh

Niels Bohr (1885-1962) fue el precursor de la mecánica cuántica al exponer el espectro del átomo de hidrógeno y los problemas que no explicó Rutherford sobre su modelo del átomo planetario. En 1913 propone un modelo atómico que lleva su nombre, el cual fundamentó bajo tres postulados:
1. Cualquiera que sea la órbita descrita por un electrón, éste no emite energía, ya que las órbitas son consideradas como estados estacionarios de energía.
2. No todas las órbitas son posibles, ya que únicamente pueden existir aquéllas para las cuales el momento angular del electrón sea un múltiplo entero (h con barra), en donde (h) es la constante Planck (6.62 X 10-34 J. s).
3. La energía liberada al pasar a una órbita inferior desde una órbita superior (del nivel de energía E2 al nivel de energía E1) se emite en forma de cuanto de luz (fotón). Así, la frecuencia (f) del cuanto viene dada por la fórmula:
E2 - E1 = hf
Sin embargo, los postulados de Bohr contradicen equivocada y sorprendentemente los fundamentos teóricos de James C. Maxwell, que son tan válidos y actuales como el mismo día en que Maxwell los propuso.
Aun así, las aportaciones científicas sobre la concepción de la luz y la energía propuestas por Maxwell, Planck y Einstein motivaron a Niels Bohr a proponer una explicación sobre el espectro de emisión de los gases en el átomo de hidrógeno, como un modelo funcional que explica el funcionamiento atómico mediante la herramienta matemática, expresada en ecuaciones sencillas, por lo que gracias a lo simple que es este modelo, todavía en la actualidad se usa para sintetizar la explicación sobre la estructura de la materia en términos atómicos.
El modelo atómico propuesto por Bohr explica que el núcleo del átomo de hidrógeno contiene una partícula central llamada protón y girando a su alrededor se encuentran los electrones. Estos electrones giran en órbitas circulares alrededor del núcleo, donde ocupan la menor energía posible, que puede hallarse en la órbita más cercana al núcleo; además, observó que los electrones se mueven únicamente en ciertas órbitas y no en otras, y que cada una de ellas está caracterizada por un nivel de energía diferente, de tal suerte que cuando un electrón pasa de un nivel a otro se desprende cierto tipo de energía liberada por ese salto cuántico.
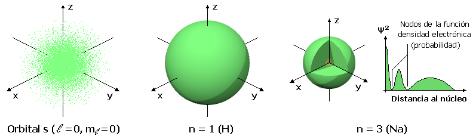
1.6 Modelo Mecánico Cuántico de Schrodinger
Erwin Schrödinger (1887-1961) obtuvo el premio Nobel de Física en 1933 por su desarrollo científico en la mecánica cuántica. En 1926 publicó las bases de la mecánica cuántica ondulatoria, según la cual la materia se comporta a la vez como onda y partícula.
Schrödinger dedujo en derivadas parciales la ecuación diferencial que relaciona la energía con una partícula microscópica en función ondulatoria. Con esta ecuación diferencial se obtienen resultados en función de ondas relacionadas con la probabilidad de que se dé determinado suceso físico.
En síntesis, el modelo de la mecánica cuántica de Schrödinger se puede explicar del siguiente modo:
· Las soluciones de la ecuación de onda (ecuación diferencial) se conocen como funciones de onda u orbitales.
· La función de onda Ψ2 define solamente la probabilidad de encontrar al electrón e- en una región del espacio alrededor del núcleo atómico, ya que Heisenberg demostró que no se puede saber la posición exacta que ocupa el electrón e-.
· Los parámetros conocidos como números cuánticos describen el nivel de energía de un orbital y la forma tridimensional de la región del espacio ocupada por un e- dado.
· Los números cuánticos son:
a) Número cuántico principal: η
b) Número cuántico angular: ℓ
c) Número cuántico magnético: µ ℓ
En donde el número cuántico principal η es un número entero positivo del que dependen principalmente el tamaño y la energía del orbital, y conforme aumenta el valor de η (1, 2, 3, 4, 5…) aumenta el tamaño del orbital y el electrón e- se encontrará más lejos del núcleo. Como consecuencia del aumento de la distancia entre el e- y el núcleo, la energía de ese e- aumenta al aumentar el valor de η.
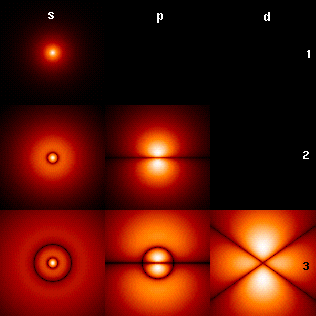
El número cuántico angular ℓ define la forma tridimensional del orbital y cada número cuántico angular corresponde a un subnivel de energía para los orbitales de un átomo.
Estos subniveles son:
s : Sharp (nítido)
p : Principal (principal)
d : Diffuse (difuso)
f : Fundamental (fundamental)
El número cuántico magnético µ ℓ define la orientación espacial del orbital con respecto a un conjunto de ejes coordenados estándar. Toma valores enteros, tanto negativos como positivos (-3, -2, -1, 0, 1, 2, 3…).
Es por ello importante conocer el Principio de Incertidumbre de Heisenberg, que propuso en 1917 el físico alemán Werner Heisenberg (1901-1976). Este principio afirma que son las reglas de la probabilidad que gobiernan las partículas subatómicas, nacen de la paradoja que dos propiedades relacionadas con una partícula y no pueden ser medidas exactamente al mismo tiempo.
Un observador puede determinar o bien la posición exacta de una partícula en el espacio que la ocupa o su momento exacto (cantidad de movimiento), que es el producto de la velocidad por la masa, pero nunca ambas cosas simultáneamente, ya que en cualquier intento de medir ambos a la vez los resultados presentan sesgos e imprecisiones.
1.7 Configuración Electrónica de los Elementos

Para revisar el tema sobre la configuración electrónica de los elementos es necesario recordar la definición de átomo.
· Partícula (1 a 5ºA)
· Compuesta por protones (+), neutrones (+/-) y electrones (-)
· Lo que determina a un elemento es el número de protones que lo componen
· Su estructura y enlaces definen las propiedades químicas y físicas de los materiales
Por lo tanto, la configuración electrónica es la descripción de la forma en que los orbitales de un átomo están ocupados por sus electrones, en donde el orden de llenado de los orbitales se rige por el principio Aufbau, que significa construcción en el idioma alemán. Este principio se explica de la siguiente manera:
· Los orbitales de menor energía se llenan primero
· Un orbital sólo puede tener 2 e- con espines opuestos (+1/2, -1/2)
Si hay disponibles dos o más orbitales de la misma energía, los e- primero se colocan de uno en uno hasta que queden semillenos; sólo entonces un segundo e- llena cada uno de los orbitales.
1.8 Calculo de Partículas Subatómicas
Ernest Rutherford, conocido también como Lord Rutherford, nació en Brightwater, Nueva Zelanda, el 30 de agosto de 1871 y murió en Cambridge, Reino Unido, el 19 de octubre de 1937. Fue un físico y químico neozelandés de gran relevancia en el entendimiento de la estructura atómica. El modelo propuesto por Rutherford fue el primer modelo atómico que consideró la estructura del átomo formado por dos partes:
· La parte exterior denominada corteza (luego denominada periferia), constituida por todos sus electrones girando a gran velocidad en un núcleo.
· Una parte llamada núcleo, muy pequeña, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo, en el cual el átomo posee un núcleo o centro donde se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.
Las partículas alfa referidas por Rutherford, identificadas por el símbolo griego alfa (α), son núcleos radicales completamente ionizados de helio-4 (4He) por efecto de radiación espacial o de influencia directa de elementos radiactivos, es decir, sin su correspondiente envoltura de electrones. Estos núcleos ionizados están formados por dos protones y dos neutrones, sin electrones. Al carecer de éstos, su carga eléctrica es positiva (+2qe), mientras que su masa es de cuatro unidades de masa atómica (4He).
1.8.1 Conceptos de Ion e Isotopo
La palabra ion proviene del griego y significa “el que va” o “el viajero” y es un átomo o grupo de átomos que puede tener carga neta, ya sea positiva o negativa. Así, la ionización es la formación de moléculas o átomos con carga eléctrica, en donde los átomos tienen una carga neta neutra, ya que los electrones con carga eléctrica negativa son iguales a los protones con carga eléctrica positiva.
Así, la pérdida de uno o más electrones a partir de un átomo neutro forma un catión, que es un ion con carga eléctrica neta positiva, mientras que un anión tiene una carga eléctrica neta negativa debido a un incremento en el número de electrones.
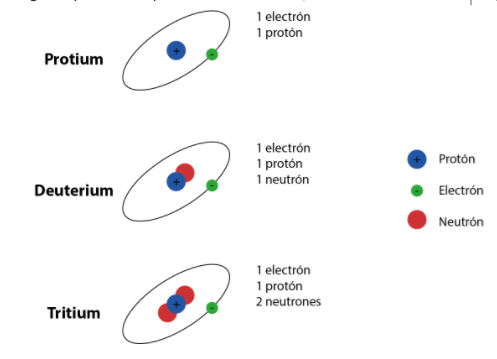
Por su parte, los isótopos son átomos de un mismo elemento químico que tiene el mismo número de protones, pero con una diferencia en su peso atómico, esto se debe a que por lo general poseen uno o más neutrones. La gran mayoría de estos átomos isotópicos son inestables y con un corto periodo de vida, ya que al paso del tiempo se desintegran en elementos menos densos.
Un ejemplo puede ser, el hidrógeno y sus isótopos más conocidos, como los de Protio (11H+), Deuterio (21H+) y Tritio (31H+).
Esta diferencia es el número de neutrones en los elementos nombrados como radioisótopos, descubiertos en el siglo XX, en el marco de los primeros estudios sobre la radiactividad en las primeras décadas de ese siglo, por el científico británico Frederick Soddy, quien fue galardonado con el premio Nobel de Química en 1921.
1.8.2 Como Calcular Las Partículas Subatómicas
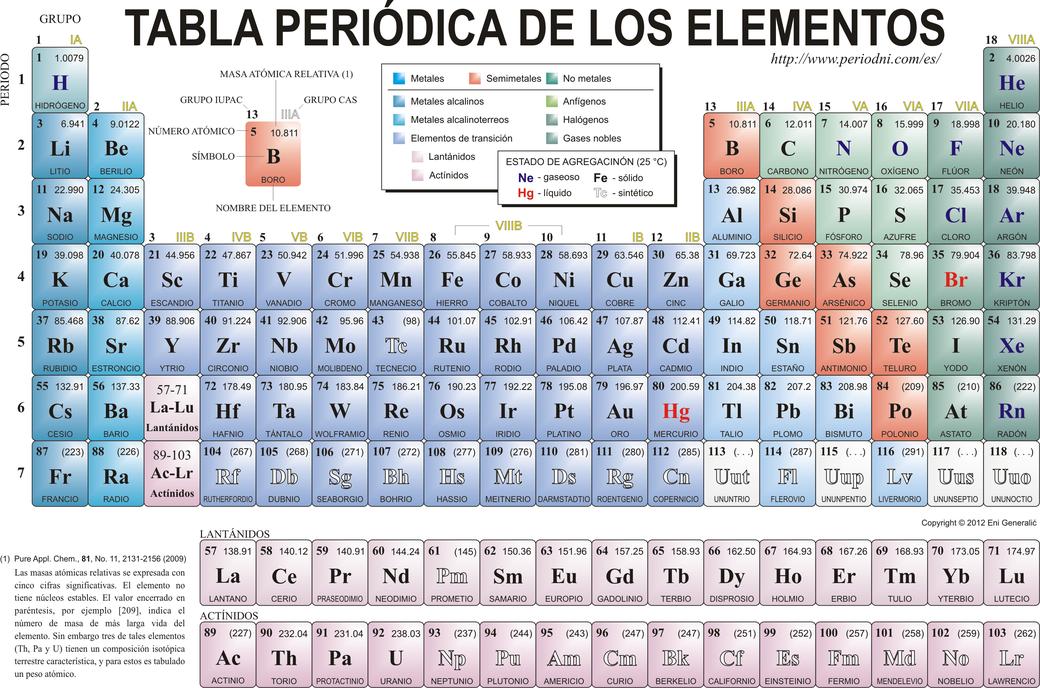
Las partículas subatómicas que conforman la composición de los átomos son los protones (+), neutrones (+/-) y electrones (-). Es por ello que para calcular la cantidad de partículas subatómicas que hay en un átomo es necesaria la utilización de la tabla periódica de los elementos, bajo las siguientes instrucciones:
· Localizar el número atómico del elemento que se quiera calcular en la tabla periódica.
· Determina el número de electrones usando el número atómico. Considerando que un átomo tiene una carga eléctrica neutra, el número atómico es también el número de electrones que contiene.
· Calcula el número de neutrones tomando el número másico de la tabla periódica y restando el número de protones.
· Para el cálculo de los isótopos, recordar que el número de electrones y protones es igual al número atómico.
· Para calcular el número de neutrones se resta el número atómico al número de isótopos, v. g., el carbono 14 tiene una masa de isótopos de 14 y 6 protones, por lo que el número de neutrones es igual a 8.
Hay que recordar que los isótopos son elementos que difieren en masa, puesto que la masa se deriva del núcleo y los protones dan identidad de un elemento, así, el número de electrones difiere en isótopos.
1.9 Grupos de la Tabla Periódica
Johann Wolfang Döbereinger (1780-1849), profesor de la Universidad de Jena, intentó clasificar los elementos químicos (tríadas de Döbereinger) conocidos en su época, agrupándolos por afinidades y semejanzas. Este químico de origen alemán elaboró en 1817 un informe en el cual mostró la relación que existe entre la masa atómica de ciertos elementos químicos y las propiedades que guardan entre sí.
John Alexander Reina Newlands (1837-1898) observó que los elementos químicos pueden ser ordenados según su masa atómica, ya que presentan cierta periodicidad; de esta manera demostró varias series de ocho elementos, las cuales se conocen como octavas de Newlands.
Julius Lothar Meyer (1830-1895) fue profesor de química en Bresiau y en el Instituto Politécnico de Karisuhe. En el año de 1876 laboró como docente en Tubinga, en donde sus estudios se orientaron a la química física e inorgánica y elaboró un sistema de clasificación periódica de los elementos químicos similares por su volumen atómico.
Dmitri Ivanovich Mendeléiev (1834-1907) fue un químico de origen ruso que se formó en el Instituto Pedagógico de San Petersburgo y amplió sus estudios en la ciudad alemana de Heildelberg. Mendeléiev demostró que las propiedades de los elementos químicos están en función periódica de sus pesos atómicos, y mediante la clasificación de dichos elementos logró que aquellos que tuvieran un comportamiento químico similar pudieran ser colocados en una tabla dentro de una columna vertical, formando así un solo grupo a cuyas líneas horizontales llamó periodos.
Los grupos están organizados en las columnas de la tabla periódica. Hay 18 grupos numerados ordinalmente (del 1 al 18). Los elementos situados en dos filas fuera de la tabla pertenecen al grupo 3.
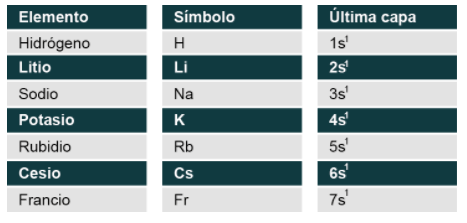
Se advierte además que en un grupo las propiedades químicas de los elementos son muy similares, ya que todos los elementos que conforman ese grupo tienen el mismo número de electrones en su última o últimas capas. Por ejemplo, la configuración electrónica de los elementos del primer grupo es igual, lo que varía es el periodo del elemento.
1.10 Periodos de la Tabla Periódica
El orden de los elementos químicos se expresa en la tabla periódica, acuñada de manera que aquéllos con propiedades químicas semejantes se encuentran situados cerca uno del otro. Así, los elementos se organizan en filas horizontales llamadas periodos.
Sin embargo, es necesario aclarar que los periodos no son todos iguales, sino que el número de elementos que contienen es dinámico y es creciente al avanzar en los periodos de la tabla periódica, de manera que el primer periodo tiene sólo dos elementos, el segundo y el tercero tienen ocho elementos, el cuarto y el quinto tienen 18, el sexto periodo tiene 32 elementos y el séptimo periodo no tiene los 32 elementos, ya que aún no se han descubierto los elementos restantes para ese periodo.
Los últimos periodos tienen 14 elementos, separados con la finalidad de no alargar demasiado la tabla y poder facilitar su manejo.
Es importante precisar que el periodo que ocupa un elemento coincide con su última capa electrónica; así, un elemento con cinco capas electrónicas estará en el quinto periodo, un elemento con cuatro capas estará en el cuarto periodo y así sucesivamente.
1.11 Bloques de la Tabla Periódica
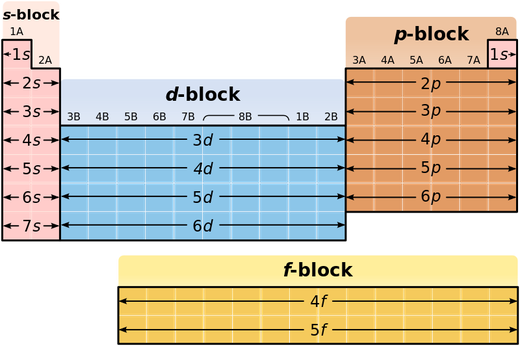
La tabla periódica de los elementos químicos se divide en bloques de acuerdo al orbital que estén ocupando los electrones más externos. Para ello es necesario ubicar el nombre de dicho orbital (s, p, d, f). Debería haber más bloques en la tabla, sin embargo, todavía no se han sintetizado o descubierto; llegado el caso, el siguiente bloque por descubrir sería el g y se continuaría en un orden alfabético para describirlo.
Recursos de la Unidad 1
Continua el Curso !
Bibliografía
· Nelson, P. (2008). Biological Phisics: energy, information, life. (4th edition). United States of America: Freeman.
Sears, F. W. & Zemanzqui, M. W. (1977). Física General. (5ª edición). España: Aguilar.
Direcciones electrónicas
· Biografías y Vidas (s/f). “Dmitri Ivanovich Mendeléiev”. Recuperado en febrero de 2016. Consultado en: http://www.biografiasyvidas.com/biografia/m/mendeleiev.htm
· Campoamor, C. (s/f). “La tabla periódica”. Recuperado en febrero de 2016. Consultado en: http://fresno.pntic.mec.es/~fgutie6/quimica2/ArchivosPDF/07TablaPeri%F3dica.pdf
· IES. La Magdalena. Avilés. Asturias (s/f). “Modelo atómico de Rutherford”. Recuperado en febrero de 2016. Consultado en: http://web.educastur.princast.es/proyectos/fisquiweb/Apuntes/Apuntes2Qui/Bohr_Sommerfeld.pdf
· IES. La Magdalena. Avilés. Asturias (s/f). “Principio de Incertidumbre”. Recuperado en febrero de 2016. Consultado en: http://web.educastur.princast.es/proyectos/jimena/pj_franciscga/heisenberg.htm
· Institute for Human & Machine Cognition (s/f). “Modelo atómico de Thomson”. Recuperado en febrero de 2016. Consultado en: http://cmapspublic.ihmc.us/rid=1HC67ZLDF-16KXG1M-ZS9/Modelo%20de%20Thomson.pdf
· Lenntech, BV (s/f). “Historia de la tabla periódica”. Recuperado en febrero de 2016. Consultado en: http://www.lenntech.es/periodica/historia/historia-de-la-tabla-periodica.htm
· López, N. (s/f). “Tabla periódica y configuraciones electrónicas”. Recuperado en febrero de 2016. Consultado en: http://depa.fquim.unam.mx/amyd/archivero/TPyConfigElectronicas_21448.pdf
Ministerio de Educación, Cultura y Deporte de España (s/f). “El Átomo y los Modelos atómicos”. Recuperado en febrero de 2016. Consultado en: http://recursostic.educacion.es/secundaria/edad/3esofisicaquimica/impresos/quincena5.pdf
Recuerda Leer Política de privacidad antes de usar este sitio.