Química Inorgánica Unidad 3
Reacciones Químicas, Balanceo de Ecuaciones y Estequiometria.
Temario
3.1 Reacciones de síntesis
3.2 Reacciones de descomposición
3.3 Reacciones de sustitución simple
3.4 Reacciones de sustitución doble
3.5 Balanceo por tanteo
3.6 Balanceo por método algebraico
3.7 Conversión estequiométrica mol-mol, mol-masa,
masa-masa
3.7.1 Conversión estequiométrica mol-masa
3.7.2 Conversión estequiométrica masa-masa
3.8 Reactivo limitante
3.1 Reacciones de Síntesis
Las reacciones de síntesis o adición se identifican característicamente porque los reactivos se unen en el producto en sólo una sustancia. La representación esquemática de esta ecuación es A + B → AB, que se puede representar en los siguientes ejemplos:
· Na + Cl → NaCl Sodio y cloro a sal común
H2O + CO2 → H2CO3 Agua y dióxido de carbono a ácido trioxocarbónico
3.2 Reacciones de descomposición

Las reacciones de descomposición o de análisis originan productos más simples que el reactivo inicial; son reacciones contrarias a las de síntesis. La representación gráfica de esta ecuación se representa en los siguientes ejemplos:
3.3 Reacciones de Sustitución Simple

Estas reacciones se caracterizan porque en ellas un elemento sustituye y libera a otro presente en un compuesto o en una sustancia, que se representa mediante la siguiente ecuación: A: + :AB: → :AC: + B:. Así, el elemento libre sustituye a uno de los elementos del compuesto o de la sustancia, siempre y cuando sea más reactivo. Por lo regular y para el caso de los metales, un metal libre reemplaza a otro metal en el compuesto que es menos electropositivo que aquél, y para el caso de los no metales, de igual manera se reemplazan por no metales en un compuesto si es menos electronegativo.
3.4 Reacciones de Sustitución Doble
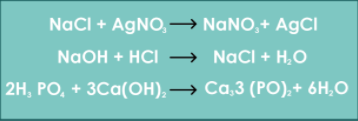
En este tipo de reacciones dos compuestos químicos intercambian iones para producir dos nuevos compuestos. Por lo regular, los compuestos iónicos participantes se encuentran en solución acuosa y la ecuación que las describe es : :AB: + :CD: → :AD: + :CB:, en donde se observa la presencia de iones A+ y B- en AB y los iones C+ y D- en CD.
El balanceo de ecuaciones es la consecuencia de la ley de conservación de la masa de Antoine-Laurent de Lavoisier (1743-1794), considerado como padre de la química moderna. Esta ley afirma que la masa de los reactivos utilizados debe ser igual a los productos obtenidos, ya que la cantidad y la variedad de átomos presentes en los reactivos debe mantenerse en la totalidad de los productos, pues lo único que cambia es la manera en que están combinados.
En este tipo de reacciones dos compuestos químicos intercambian iones para producir dos nuevos compuestos. Por lo regular, los compuestos iónicos participantes se encuentran en solución acuosa y la ecuación que las describe es : :AB: + :CD: → :AD: + :CB:, en donde se observa la presencia de iones A+ y B- en AB y los iones C+ y D- en CD.
Explicado de otra manera, el balanceo de ecuaciones es el método para encontrar los coeficientes estequiométricos, en una reacción química tal que la cantidad de átomos presentes en los reactivos sea igual a aquellos presentes en los productos; ejemplo:
Fe2O3 + C → Fe + CO se balancea como Fe2O3 + 3C → 2Fe + 3CO
Si se cumple la condición de que la cantidad de átomos presentes antes y después de la reacción son los mismos, entonces la suma de la masa de los reactivos es necesariamente igual a la suma de la masa de los productos, de acuerdo con la ley de conservación de la masa propuesta por Lavoisier.
Así, el balanceo es un procedimiento sencillo, que para el caso de reacciones de óxido-reducción (redox), es necesario balancear tanto la masa como la carga eléctrica del ion, por lo que se te aconseja aprender a balancear reacciones redox para poder balancear reacciones ácido-base sin mayor dificultad.
3.5 Balanceo por Tanteo
Balancear ecuaciones químicas es ecualizar la cantidad de sustancias que intervienen en una reacción entre elementos y/o sustancias químicas, esto para que correspondan con la cantidad de sustancias producidas de tales reacciones, y que los elementos que reaccionan en el primer miembro de la ecuación sean los mismos (cantidad) que queden después de la reacción en el segundo miembro de la ecuación.
El método por tanteo es considerado como el método de ensayo y error, ya que se intenta equilibrar el número de átomos en la ecuación química, modificando los valores de las sustancias presentes de uno o ambos lados, a efecto de que exista igualdad entre el número de átomos de las sustancias reaccionantes y las sustancias producidas.
Ejemplo de la reacción de neutralización del ácido sulfúrico con el ácido clorhídrico:
Na2SO3 + HCl → NaCl + H2O + SO2
En el lado izquierdo (primer miembro) de la ecuación están las sustancias reaccionantes: ácido sulfúrico (Na2SO3) y ácido clorhídrico (HCl). Del lado derecho (segundo miembro) de la ecuación, se observan los productos de la reacción: cloruro de sodio/sal común (NaCl), agua (H2O) y óxido de azufre (SO2).
Sin embargo, en esta ecuación solamente se observan las sustancias que reaccionan y las sustancias que se producen, pero en relación con sus respectivas fórmulas; por lo tanto, para saber si la ecuación está balanceada se debe contar el número de átomos de uno y otros miembros de la ecuación, y así, si la suma total es la misma de ambos lados, entonces se asegura que la ecuación (reacción) está balanceada.
2 + 1 + 3 + 1 + 1 → 1 + 1 + 2
+ 1 + 1 + 2
Na2SO3 + HCl → NaCl +
H2O + SO2
De lo anterior, se obtiene el número de átomos en el primer miembro, un número menor que el segundo miembro, por lo que se puede entender que la ecuación no está balanceada; por lo tanto, para poder balancearla se requiere identificar el número de átomos de cada elemento en ambos miembros de la ecuación.
Primer miembro: Na = 2; S = 1; O = 3; H
= 1; Cl = 1
Segundo miembro: Na = 1; S = 1; O = 3; H = 2; Cl = 1
Así, en el primer miembro de la ecuación falta un átomo de sodio, mientras que “sobra” un átomo de hidrógeno, por lo tanto, es necesario balancear la ecuación por el método de tanteo, siguiendo estas reglas:
· No se agregan elementos que no pertenezcan a la ecuación.
· No se modifican los radicales de los elementos de la ecuación, es decir, si del primer miembro el hidrógeno tiene un radical 2, debe seguir con el radical 2.
· Sí se puede expresar al aumento de átomos agregando el número de átomos de alguno de los compuestos de la mezcla. Así, si queremos expresar que hay cuatro átomos de ácido clorhídrico, escribiremos 4HCl.
· Se comienza el balanceo por los elementos que sólo aparecen una vez en cada miembro y se dejan al final los que aparecen más de una vez, si esto es necesario.
· El hidrógeno y el oxígeno son de los últimos elementos que se deben considerar para el balanceo.
Como se puede empezar a partir de cualquier miembro, empezaremos con los átomos de sodio (Na). En el primer miembro existen dos átomos de sodio para reaccionar en la molécula de sulfato de sodio (Na2SO3), mientras en el segundo miembro, en la sustancia producida, el cloruro de sodio (NaCl), sólo hay un átomo de sodio. Esto quiere decir que para equilibrar el sodio y que haya dos átomos en el resultado, debe haber dos moléculas de cloruro de sodio en el lado derecho de la reacción. Así se obtendría lo siguiente:
2 + 1 + 3 + 1 + 1 → 2 + 2 + 2
+ 1 + 1 + 2
Na2SO3 + HCl → 2NaCl +
H2O + SO2
De esta manera, ya se tiene la misma cantidad de átomos de sodio. Pero nuestra ecuación sigue desequilibrada. En efecto, ahora se tiene:
Primer miembro: Na = 2; S = 1; O = 3; H
= 1; Cl = 1
Segundo miembro: Na = 2; S = 1; O = 3; H = 2; Cl = 2
Ahora se tienen dos átomos de cloro en el resultado y sólo uno en los reactivos. Si consideramos que el resultado de la reacción produce dos átomos de sal común, y sólo hay un átomo de cloro en
la molécula reactiva, significa que ahora debemos considerar que actúan dos moléculas del compuesto que contiene el cloro, o sea, dos moléculas de ácido clorhídrico (HCl).
A manera de comprobación, se agrega a la fórmula la indicación de que están reaccionando dos átomos de ácido clorhídrico (HCl), para posteriormente realizar un nuevo conteo de los átomos, ejemplo:
2 + 1 + 3 + 2 + 2 → 2 + 2 + 2
+ 1 + 1 + 2
Na2SO3 + 2HCl → 2NaCl +
H2O + SO2
Una vez realizado lo anterior, se cuenta con el mismo número de átomos reaccionando en el primer miembro y en el segundo miembro de la ecuación.
Al existir en los dos miembros el mismo número de átomos de cada elemento, se puede decir con certeza que está correctamente balanceada, como se describe a continuación:
Primer miembro: Na = 2; S = 1; O = 3; H
= 2; Cl = 2
Segundo miembro: Na = 2; S = 1; O = 3; H = 2; Cl = 2
Se aprecia que al balancear los elementos que sólo aparecen una vez, otros átomos, en este caso del hidrógeno (H), cambian sus valores dependiendo de la molécula en la que se encuentran
combinados y la cantidad de moléculas que actúan en la ecuación, equilibrándose de esta manera el resto de los elementos.
3.6 Balanceo por Método Algebraico

Por lo general, las reacciones químicas se expresan como ecuaciones que, si están escritas correctamente, en todos los elementos que participan en la reacción se deben ajustar (balancear) el número de átomos tanto de los reactivos como de los productos, para igualar la cantidad de átomos en ambos lados (miembros) de la ecuación.
El método algebraico para realizar el balanceo de ecuaciones de sustancias químicas dadas es un proceso matemático en el que se asignan literales (letras) a cada uno de los elementos participantes (nomenclatura química), para crear ecuaciones dependiendo de los átomos, y al balancear dichas ecuaciones se pueda determinar el valor de los coeficientes de dichas literales.
Ejemplo, para balancear:
FeS (sulfuro de hierro) + O2 (oxígeno) → Fe2O3 (óxido de hierro)+ SO2 (dióxido de azufre)
Se escribe una letra (literal) en orden alfabético, empezando por A, sobre los elementos participantes de la ecuación:
|
A |
B |
C |
D |
|||
|
FeS |
+ |
O2 |
a |
Fe2O3 |
+ |
SO2 |
Se procede a escribir los elementos y establecer para cada uno de ellos la cantidad de reactivos y de productos, con respecto a la variable. Es decir, para un Hierro (Fe) en reactivos y dos en productos, pero en función de las literales donde se localizan los elementos (A y C) se establece la ecuación A = 2C.
El símbolo que se produce en la ecuación “→” equivale al signo igual (=).
Fe A = 2C
S A = D
O 2B = 3C + 2D
Posterior al uso de tales ecuaciones, se da un valor a cualquier letra que nos permita resolver una ecuación (obtener el valor de una literal o variable) y así, se obtiene después el valor de las variables restantes. Después se asigna un valor al azar (generalmente se le asigna el 2) a alguna variable en una ecuación, en este caso C = 2, de tal forma que al sustituir el valor en la primera ecuación se encontrará el valor de A. Sustituyendo el valor de A en la segunda ecuación se encuentra el valor de D y finalmente en la tercera ecuación se sustituyen los valores de C y D para encontrar el valor de B.
|
A |
|
B |
|
C |
|
D |
|
FeS |
+ |
O2 |
= |
Fe2O3 |
+ |
SO2 |
Fe A = 2C si C =2 A = D 2B = 3C + 2D
S A = D A = 2C D = 4 2B = (3)(2) + (2)(4)
O 2B = 3C + 2D A = 2(2) 2B = 14
A = 4 B = 14/2 B = 7
Al finalizar se obtiene la ecuación balanceada por el método algebraico, esto una vez asignados los valores a cada una de los elementos para cada una de las variables:
|
A |
|
B |
|
C |
D |
|
|
4 FeS |
+ |
7 O2 |
= |
2Fe2O3 |
+ |
4SO2 |
3.7 Conversión Estequiometrica mol-mol, mol-masa, masa-masa
La estequiometría estudia las relaciones cuantitativas que existen entre las sustancias químicas que intervienen dentro de una reacción. Las relaciones pueden ser entre reactivos y productos, sólo entre reactivos o sólo entre productos; por lo tanto, las reacciones que se estudiarán en este curso son mol-mol, mol-masa y masa-masa.
El alumno conocerá la trascendencia de la determinación de las cantidades de reactivos y productos involucrados en una reacción química y valorará la importancia que tienen este tipo de cálculos en el análisis cualitativo de procesos químicos.
Se encarga de nombrar las sustancias químicas usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. Esta atomicidad indica el número de átomos de un mismo elemento en una molécula, como ejemplo el agua con su fórmula H2O, que significa que hay un átomo de oxígeno (O) y dos átomos de hidrógeno (H2) presentes en cada molécula de este compuesto, aunque de manera más práctica, se refiere a la proporción de cada elemento en una cantidad determinada de sustancia.
Todos los cálculos estequiométricos se deben realizar en base a una ecuación balanceada para que el resultado sea correcto; se debe considerar también que la parte central de un problema estequiométrico es el factor molar (moles de la sustancia deseada dividido entre los moles de la sustancia de partida), por lo que es importante saber que los datos para calcular el factor molar se obtienen de los coeficientes de la ecuación balanceada.
La sustancia deseada se presenta como incógnita y la sustancia de partida como dato (moles, gramos, litros); se utilizan corchetes para indicar el factor molar y paréntesis para los factores de conversión.
En una conversión estequiométrica mol-mol, la sustancia de partida está expresada en moles y la sustancia deseado se pide en moles. Antes de realizar la conversión es necesario redondear las cifras a dos decimales y de igual manera, las masas de los elementos químicos deben redondearse a dos decimales.
Para redondear una cifra se aplica el siguiente criterio: se usa como base el decimal ubicado en la tercera posición; si éste decimal es mayor o igual al numeral 5 se aumentará una unidad al segundo decimal, pero si es menor o igual a 4 se conservará la cifra del segundo decimal.
Recursos
Bibliografía
· Nelson, P. (2008). Biological Phisics: energy, information, life. (4th edition). United States of America: Freeman.
Sears, F. W. & Zemanzqui, M. W. (1977). Física General. (5ª edición). España: Aguilar.
Direcciones electrónicas
· Bowen, A. (2015). “Unidad 3. Relaciones cuantitativas”. Recuperado el 19 de abril de 2016. Consultado en: http://modulo-de-quimica.blogspot.mx/2015/07/unidad3-relaciones-cuantitativas.html
Caballero, R. Quintero, L. & Morales, P. (s/f). “Balanceo de ecuaciones químicas”. Recuperado el 19 de abril de 2016. Consultado en: http://quimicaconraiza.es.tl/BALANCEO-DE-ECUACIONES-QUIMICAS.htm
· Redacción Ejemplode.com (2016). Ejemplo de balanceo de ecuaciones por tanteo. Recuperado el 19 de abril de 2016. Consultado en: http://www.ejemplode.com/38-quimica/3946-ejemplo_de_balanceo_de_ecuaciones_por_tanteo.html
(S/a) (s/f). Guía conceptual de cálculos estequiométricos. Recuperado en abril de 2016. Consultado en: http://files.ciencias-naturales-colegio-upb.webnode.es/200000056-5652c574cb/Gu%C3%ADa%20conceptual%20C%C3%A1lculos%20estequiom%C3%A9tricos%20Qu%C3%ADmica%20und%C3%A9cimo.docx
Recuerda Leer Política de privacidad antes de usar este sitio.



Escribir comentario